医薬品メーカーは、動物実験や臨床試験などのいろいろな試験を実施し、医薬品としての有効性や安全性について確かめているわけですが、メーカーが自分で自分のデータを評価して、効くとか、安全だというデータがたくさんあるといっても、それだけで医薬品を製造したり販売したりするわけにはいかないように薬事法(現:医薬品医療機器法)は規定しています。
医薬品は人の生命、健康に直接関わるものですから、市販の前に公的な認証を必要とすることとしているのは外国でも同様です。
わが国の場合、この市販前の認証制度として承認と許可があります。では、医薬品の承認許可制度とはどんな制度でしょうか。まず承認について規定を見てみましょう。
医薬品の承認許可制度

(医薬品、医薬部外品及び化粧品の製造販売の承認)
第14条 医薬品(厚生労働大臣が基準を定めて指定する医薬品を除く。)、医薬部外品(厚生労働大臣が基準を定めて指定する医薬部外品を除く。)又は厚生労働大臣の指定する成分を含有する化粧品の製造販売をしようとする者は、品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない。
ある物質が医薬品として医療機関で実際に使用されたり、薬局で消費者に販売されたりするためには、その医薬品の品質や、本当に医薬品としての効果があるか、安全性は大丈夫かなどについてきちんとした公正な第三者の評価を受けたものである必要があります。
上記の条文では、ある物質について、それを医薬品として製造販売しようとする者は、品目ごとに厚生労働大臣の審査を受け、「承認」を受けなければならない、ということを規定しています。
次に「許可」についてです。まず条文をみてみましょう。
(製造販売業の許可)
第12条 次の表の上欄に掲げる医薬品(体外診断用医薬品を除く。以下この章において同じ。)、医薬部外品又は化粧品の種類に応じ、それぞれ同表の下欄に定める厚生労働大臣の許可を受けた者でなければ、それぞれ、業として、医薬品、医薬部外品又は化粧品の製造販売をしてはならない。
医薬品、医薬部外品又は化粧品の種類 許可の種類 第49条第1項に規定する厚生労働大臣の指定する医薬品 第一種医薬品製造販売業許可 前項に該当する医薬品以外の医薬品 第二種医薬品製造販売業許可 医薬部外品 医薬部外品製造販売業許可 化粧品 化粧品製造販売業許可
医薬品を製造販売しようとする者は、厚生労働大臣の許可を受けなければならないという規定です。
先程の第14条の「承認」は、医薬品そのものが、医薬品としての性能、つまり疾病や治療や診断、予防に本当に効果があるか、品質や安全性は大丈夫かについて品目ごとに審査を受けて与えられるものです。
これに対して「許可」は、これからその承認を受けた医薬品を製造販売しようとする者が、その医薬品の品質管理や製造販売後の安全管理をきちんと行う能力をもっているかについての審査をして与えられるものです。
このように、薬事法は、医薬品そのものの有効性や安全性、そして、それを製造販売しようとする者の管理能力をチェックするという二重の縛りをしているわけです。
次の条文をみてください。第2条第13項に「製造販売」という言葉が、次のように規定されています。
薬事法第2条第13項
13 この法律で「製造販売」とは、その製造(他に委託して製造をする場合を含み、他から委託を受けて製造をする場合を除く。以下「製造等」という。)をし、又は輸入をした医薬品(原薬たる医薬品を除く。)、医薬部外品、化粧品、医療機器若しくは再生医療等製品を、それぞれ販売し、貸与し、若しくは授与し、又は医療機器プログラム(医療機器のうちプログラムであるものをいう。以下同じ。)を電気通信回線を通じて提供することをいう。
薬事法では、従来、医薬品の有効性や安全性は、「その医薬品を製造したメーカー」が責任を負うという考え方でした。つまり、医薬品は、それを発売する者が「自ら製造するべき」という考え方でした。そうでないと、医薬品の品質を十分管理することはできないという考え方だったわけです。
ですから、製薬企業は、医薬品を製造し、発売するためには、医薬品の製造承認を取り、自ら製造工場を持つことが原則でした。
平成17(2005)年に改正された薬事法(現:医薬品医療機器法)では、どこで製造したかよりも、「その医薬品を社会に売り出した者、つまり発売元が責任を負う」という考え方に立って、必要な規制を行うこととされました。
つまり、製造販売承認はもちろん自ら取りますが、その医薬品の製造については自分で行ってもよいし、下請けメーカーに任せてもよいとされたのです。
ただし、その医薬品の有効性や安全性についての責任は、承認・許可を取得した者が取らなければならないこととされたのです。それが、「製造等」の「等」で、条文中のかっこ書き(他に委託して製造する場合を含む)の意味です。
するとどういうことが起こってくるでしょう。
たとえば、これまで錠剤やカプセル剤などの内服薬だけを製造していた会社が、初めて注射薬の製造販売承認を取ったとします。これまでならその会社は、注射薬工場を新たに建てなければなりませんでした。しかし、改正薬事法では、注射薬の専門工場を持つどこかのメーカーに製造を委託してしまうことができます。
企業にとっては、工場を建てたり、機械を整備したりという余計な設備投資をする必要がなくなったわけです。
ですから、薬事法の改正後、今まで自分の工場で製造していた製品を他のメーカーに委託製造して合理化を図ろうという企業も出てくるなど、この改正は、製薬企業にとっては経営の合理化を進めるうえでたいへん意味の大きな改正となりました。
「製造販売」には、「輸入して販売する場合」も含まれる

「製造販売」には、もうひとつ理解しておく必要があることがあります。もう一度、第2条の定義をみてください。
それは、製造販売には、「輸入して販売する」ことも含まれている、ということです。
つまり、「他に委託して製造する」とは、国内のメーカーに委託して製造するだけでなく、「外国のメーカーに委託して製造する場合を含んでいる」ということです。
ですから、例えば、製造コストの安い中国などの海外のメーカーに委託して製造し、それを輸入して販売する場合、旧薬事法では「輸入販売業」の許可が必要でしたが、改正された薬事法(現:医薬品医療機器法)では、それも「製造販売」に含まれることになったのです。
さらには、アメリカで開発された医薬品など全くの外国オリジナルの製品を輸入する場合も、外国で製造してもらって輸入し、販売するという意味で、やはり「製造販売」行為に含まれるとされているのです。
「業として」の意味

それから、第12条にある「業として」のという言葉ですが、「業として」というのは、平たくいえば、商売として、ということです。つまり、事業として、他への販売、授与を目的として製造が行われたかどうかということです。
「業か、業でないか」の判断はたいへん難しいのですが、普通、「その製造販売行為が繰り返し行われているか」あるいは「一度でも大量に製造販売されたか」、「少量でも、金額的に大きなものかどうか」などで判断されます。
市場予測・売上予測の目的

国内市場で後発医薬品のシェアが拡大する中で、長期収載品は苦戦傾向が続いています。
薬価算定方式の見直しによって、後発医薬品への置き換えが進んでいなければ最大2%の薬価引き下げが実施されることが決まったため、今後はさらに厳しい状況に置かれます。
成長ドライバーとなる新薬がない企業は窮地に立たされますが、収益源として各社が期待する新製品も予想と実績とで大きな乖離を生んでいます。
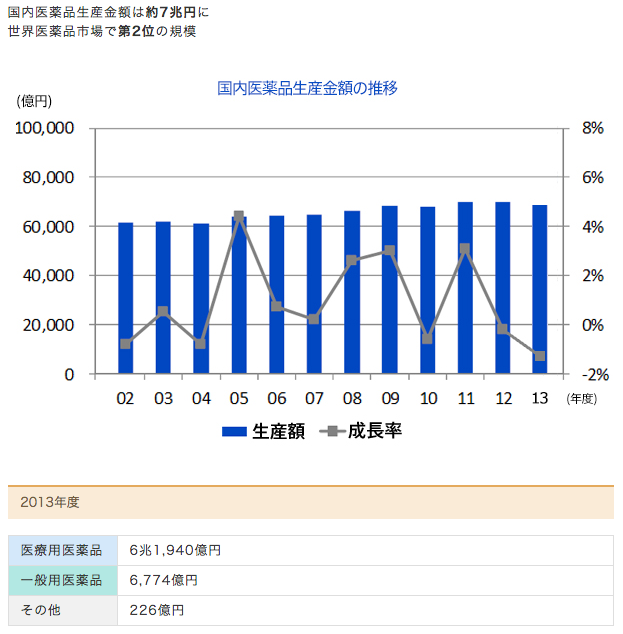
引用元:田辺三菱製薬ホームページ
製薬企業の新薬開発にあたっては、プロジェクトマネジメントの業務の一環として、開発早期(非臨床)、開発前期(PhaseⅠ,Ⅱa)、開発後期(PhaseⅡb、Ⅲ)のそれぞれの段階においてプロジェクトを次のステップに進めるべきか否かの検討や開発投資そのものに対する意思決定が重要です。
その意思決定の材料として、開発品の参入市場のポテンシャルを表す「市場予測」、あるいは開発品の参入市場における売上の獲得シナリオである「売上予測」をトップマネジメントに報告することになります。
すなわち「市場予測」を立てる工程は、「売上予測」を立てる通過点であることを意味します。したがって、以降の「売上予測」は市場予測も包括したものとみなして論を進めます。
もっとも、開発早期や前期段階では、まだ開発品の市場可能性を算定するには判断材料に乏しいことは否めず、不確実性の高い状況の中での仕事になります。
一方、上市直前および上市後は、生産工場への発注のための生産計画に必ず売上予測が必要となります。この段階での予測数字は、「物流センター⇒卸⇒医療機関」という流通量を見越しての算出となるため、精度の高い数字が求められるのは言うまでもありません。数字が大き過ぎれば、流通在庫がダブつくことになって、使用期限がある医薬品ならば欠損が生じることになります。反対に数字が小さ過ぎると、医療機関からのオーダーに間に合わず、機会損失を招くことになります。どちらも企業にとっては多大な損失です。
また、市場における競合他社品の動向と、中長期的な自社品の売上予測も事業戦略上、必要となるため、予測に携わる担当者は、製品特性を見極めつつ、競合他社品との差別化ポイントや競合他社動向など広く市場ポテンシャルを調査データから読み込んで、それらを算定材料として予測を立てることになりますので、マーケティングのセンスが問われることになるでしょう。
このように、各開発ステージおよび上市後での市場予測や売上予測は、その使用目的が異なってきます。
現在では、売上予測専用ソフトが販売されていて、必要箇所に数値を挿入するだけでスピーディに予測表が出来上がる便利な時代になっていますが、意外にも、そこから結論として出てきた数値の説明を求められると回答に窮する場合があります。ソフトを否定するわけではありませんが、バックグラウンドをしっかりと理解しないままでは、とても事業戦略に使えるものにはならないでしょう。
売上が成り立つ仕組み

売上予測を立てるためには、そもそも売上はどのような仕組みで成り立っているのかを理解しなければなりません。およそ、売上は次のような公式でまとめられます。
売上高=(潜在患者数×受療率×投薬率×自社品市場シェア×1日薬剤コスト×年間投薬日数)
1日薬剤コストは「1日投与量×単位当たり薬価」を意味します。
潜在患者から順次、ターゲットを絞り込んでいって、自社品の投薬患者に到達させれば、自社品の売上予測は算出できるわけです。
潜在患者数の中でいわゆる「未診断患者」でも薬剤によってはDTC(Direct To Consumer:患者直接広告)を仕掛けることによって医療機関に足を運んでもらい、受療患者になっていただき、市場のパイを拡大させることはできます。
このように、売上の成因は一見簡単なのですが、これらの各項目数値を割り出すには、信頼のおけるマーケットデータが必須となります。潜在患者から割り出していく方法は、売上予測の成因を理解する上では最適な方法でしょう。
一方、恐らくどの製薬企業も購入しているであろうIMSが提供しているPatient days(=投与患者数×投与日数)というデータを用いれば、潜在患者から順次絞り込んで算出する方法に比べて作業工程が一部分カットでき、容易に売上予測を算出できます。
ただ、これら2つの方法のいずれにも自社品の獲得シェア値を確定しなければならないのは同じであり、最も難しいところです。
マーケットデータ解析

売上予測を立てるのに必要なマーケットデータとしては、プライマリーデータとセカンダリーデータを収集しておかなければなりません。このうち、セカンダリーデータは、常時収集し解析しておくべきものであり、中長期的販売予測のベースになるものです。
これには、厚生労働省などの官公庁データやネット上に公開されている各種の情報など入手に困らないものから、民間調査会社に常時依頼しているものまで多岐にわたります。
一方、プライマリーデータは、セカンダリーデータだけでは解決できない当面の課題に対して付加されるべき調査データです、これには民間の調査会社が提供するパッケージ化されたものから製薬企業の特別オファーによるデータまで種類も豊富ですが、その分、コストは高くなりますので、担当者は、何が最低限必要なのか、目的意識を明らかにしておくべきです。
患者数の予測
売上予測を立てるには、潜在患者数の把握が必要であると述べました。
それでは、潜在患者をどのように調べるのかですが、これには各種の疫学データを利活用することがまず出発点です。
患者調査
疫学データには、厚生労働省が3年ごとに実施している患者調査があります。これは、調査年の10月の指定した3日間のうちの医療機関が選択した1日での患者の傷病(受療率)に関する標本調査であり、都道府県/二次医療圏別、傷病分類ごとにまとめられています。対象施設数は、約1万3000で精度は高いです。
ここで得られる「推計患者数」には「入院患者数」、「初診外来患者数」、「再来外来患者数」、「退院患者数」があります。また、「平均在院日数」や再来患者の「平均診療間隔」も掲載されています。
ただ、問題点としては、都道府県単位に傷病別死亡率にバラツキがあるため、地域特性も考慮して使わざるを得ないことと、あくまでも標本調査のため、国全体の患者実数ではないことを前提にして読み込まなければなりません。
大規模調査データ
我が国には、利活用できるデータが乏しいのが実状です。
そのような中で専門学会が独自調査しているデータも存在します。
例えば、秀逸なのは日本透析医学会が毎年調査し、学会ホームページでも公開している「わが国の慢性透析療法の現況」です。
日本透析医学会は、1968年から年に1回、全国の透析療法施設を対象に統計調査を実施しています。透析導入患者の主要原疾患のトップの座が1998年を境に慢性糸球体腎炎から糖尿病性腎症に変わったことも特筆すべきことで、当該領域の治療薬を販売している企業にとっては、信頼のおける価値あるデータとなるでしょう。
とはいえ、全体的に売上予測に利活用できる大規模調査データの数は多くないのが現状です。
中規模調査データ
前項と同様に、学会によっては独自調査を行っているところがあります。
本邦におけるヘパリン起因性血小板減少症(HIT)の診断・治療確立のためのデータ収集の目的で全国登録調査を開始している日本血栓止血学会のような例もあります。
また厚生労働省では、1996(平成8年)から「特定疾患の疫学に関する研究班」を通じて全国疫学調査を実施し、稀少難治性疾患まで含めた難病の受療患者数の推計を行ない、難病の頻度を明らかにしてきました。
さらに、死亡の地域集積性を明らかにして「難病の死亡統計データブック~地理的分布」として刊行もしています。今一度、官公庁や学会について、使えるデータを保有していないかを調べてみる必要があります。
これらはほとんどが入手に際してあまり費用がかからないデータといえるでしょう。
調査会社による市販データ
疫学データに満足いくものがなければ、市販データを活用することになります。
医薬品業界には非常に多くのデータが市販されています。その中でも売上予測における患者数を求めるには、IMSによる売上データと日本医療データセンター(JMDC)のレセプトデータの2つが現時点での有力な手段です。
売上データ
IMSによるPatient daysというデータを用いれば薬効群の「投与患者数×投与日数」がわかります。
あとは、これに自社品シェアを掛ければ自社品のPatient daysが算出できます。
さらに1日薬剤コストを掛ければ売上金額が出てくるのですが、あえて患者数を出したい場合には、Patient daysをJMDCデータから割り出した平均的投与日数で割ればよいことになります。
レセプトデータ
最近注目のJMDCが提供するデータです。レセプトデータこそ究極のマーケティングデータであると考えることができますが、日本でも徐々に充実してきたのは喜ばしい限りです。
国民皆保険ではなく、民間保険が主流となっている米国では大規模なレセプトデータベースが存在します。
お隣の韓国では、国が唯一の保険者であることから、全数ベースのレセプトデータが収集できる体制を構築している点で日本よりもかなり進んでいるといえます。
日本では2006年1月のIT新改革戦略における医療IT化推進の一環としてNDB(National Data Base)構想が進みつつあり、PMDAにおいてカルテとレセプトの2方向からプロジェクトが動いています。
レセプトデータは時系列に蓄積することによって疾病や治療のアルゴリズムがわかります。患者が転院したり、複数の医療機関に通院したとしても「個」を追跡調査できる強みをもっていることから、疾患ごとの受診頻度・医療費・検査頻度・処方傾向・年間治療日数・年間投与日がわかります。
さらに観察集団から年齢・性別ごとの母数を把握していますので、母数から発生する出現率をもとに全国推計値(患者数、投薬人数、手術人数、検査実施患者数など)を算出することが可能なのです。
JMDCが提供するレセプトデータは、我が国の全数をカバーしているわけではありませんが、統計処理を加えることによって信憑性の高い売上予測を可能とする最強のデータベースでしょう。今後、NDB事業が加速し、我が国で全数ベースのレセプトデータができ、利活用できるようになれば、医薬品マーケティングを根底から変えることになるのは間違いありません。
受療率、投薬率

受療率、投薬率ともにJMDCのデータを使えばたちどころに算出できるのですが、あえて他の方法となると、前出の厚生労働省の「患者調査」をまずは使うことになるでしょう。ただし、入院・外来の「受療率」は人口10万人に対しての概数であることは理解しておく必要があります。
また、簡便な方法としては類薬の既発売品の市場売上高を利用することです。
「既存類薬年間売上高÷(同1日薬価×同年間平均投薬日数)」を算出すれば、その類薬の市場における投薬患者数がわかります。あとは、その類薬の市場シェアをIMSデータから算出し、除することでターゲット疾患の潜在患者総数の中での薬物治療患者総数が割り出せます。これと事前に調査した潜在患者数を対比させれば、この疾患における投薬率が予測できます。売上高の公式を逆算していけば、求めたい数値にたどり着けるということです。
ただし、ここで注意すべきことはBest in class薬剤(既存薬のさまざまな点を改良した優位性のある新薬)とFirst in class薬剤(いわゆるピカ新といわれる画期的新薬)では、考え方が異なります。
前者の場合は、既存薬剤市場をターゲットとするため、既存類薬の市場売上高を材料にして予測が可能ですが、後者の場合は、ターゲット市場が大きく異なってきますので、この方法が使えません。
したがって、First in class薬剤の場合は、たとえ薬効群は異なっても、広く適応疾患領域を眺めてみて、その領域でよく使われている既存薬を参考にするか、あるいは糖尿病のように原疾患から多くの合併症が発生していることを想起しますと、治療体系全体から紐解いていく方法もあるのではないでしょうか。
これに対する作業は、かなり困難を極めることになるでしょう。また、予測数字がいたずらに肥大化する恐れもありますので、市場データから乖離した空論は避けなければなりません。
まとめ
ある物質が医薬品として医療機関で実際に使用されるためには、その医薬品の品質や効果、安全性について公正な第三者の評価を受けたものである必要があり、その仕組みが「承認」と「許可」の制度です。
製薬企業の経営は、厚生労働省による薬価制度改革や為替変動といった、企業努力だけでは対応が難しい変化の波にさらされています。
一方で新薬開発コストは年々高まり、研究開発の生産性低下を招いています。
今後はますますレセプトデータを含めたビッグデータを用いたマーケティングが重要になってきます。










コメント