| 届出番号 | K58 |
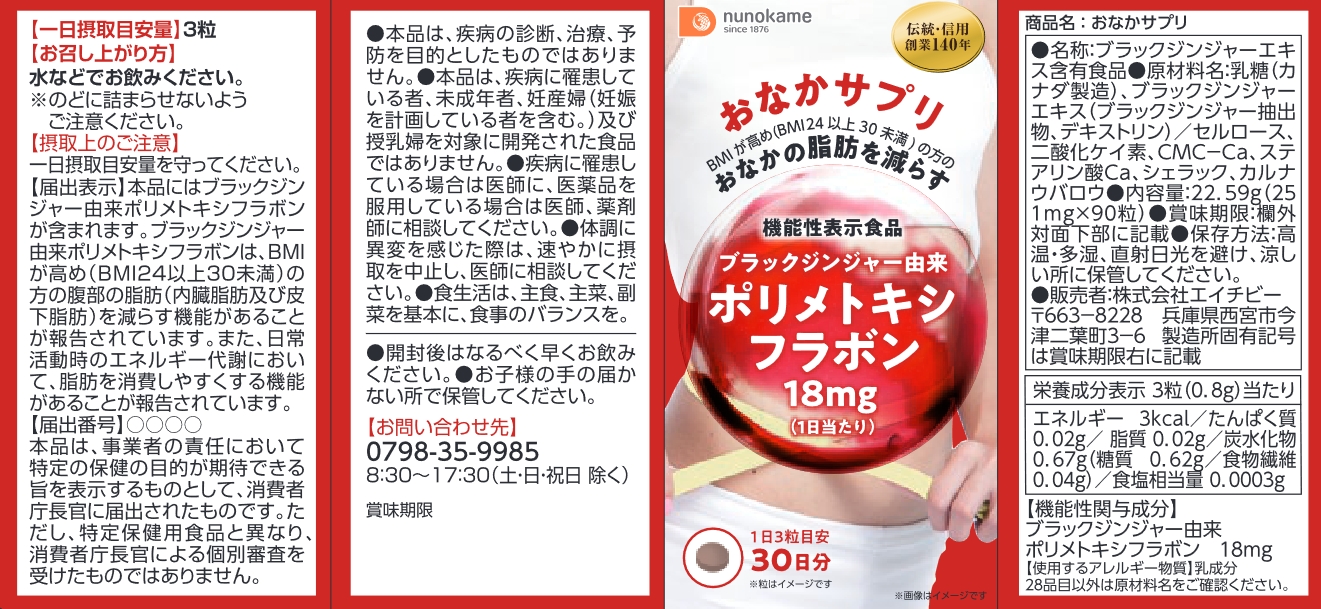
| 商品名 | ターミナリアガード |
| 届出者名 | 株式会社エクセレントメディカル |
| 届出日 | 2025/07/09 |
| 変更日 | 2025/09/17 |
| 撤回日 | – |
| 販売中 | 販売休止中 |
| 食品の区分 | 加工食品(錠剤、カプセル剤等) |
| 機能性関与成分名 | ターミナリアベリリカ由来没食子酸、 ブラックジンジャー由来ポリメトキシフラボン |
| 表示しようとする機能性 | 本品には、ターミナリアベリリカ由来没食子酸、ブラックジンジャー由来ポリメトキシフラボンが含まれます。ターミナリアベリリカ由来没食子酸には、食事に含まれる脂肪や糖の吸収を抑え、食後の中性脂肪や血糖値の上昇をおだやかにする機能、肥満気味な方のお腹の脂肪(内臓脂肪と皮下脂肪)とBMIを減らすのを助ける機能が報告されています。ブラックジンジャー由来ポリメトキシフラボンには、日常活動時のエネルギー代謝において、脂肪を消費しやすくする作用により、BMIが高め(BMI23以上30未満)の方の腹部の脂肪を減らす機能があることが報告されています。 |
| 当該製品が想定する主な対象者 | 健常成人で、食後の中性脂肪や血糖値が気になる方、肥満気味でお腹の脂肪(内臓脂肪と皮下脂肪)が気になる方、BMI が高めの健康な方(疾病に罹患している者、妊産婦(妊娠を計画している者を含む。)及び授乳婦を除く。) |
| 一日当たりの摂取目安量 | 高めのBMIや食後の中性脂肪、血糖値が気になる方は1日当たり3粒(3粒を1回)を、肥満気味でお腹の脂肪が気になる方は1日当たり6粒(3粒を2回)を目安にお召し上がりください。 |
| 一日あたりの摂取目安量当たりの機能性関与成分の含有量 | 機能性関与成分名:ターミナリアベリリカ由来没食子酸、ブラックジンジャー由来ポリメトキシフラボン 含有量:ターミナリアベリリカ由来没食子酸:3粒当たり20.8mg 6粒当たり41.6mg ブラックジンジャー由来ポリメトキシフラボン:3粒当たり 12 mg |
| 保存の方法 | 直射日光、高温多湿を避けて、保存してください。 |
| 摂取の方法 | 食事とともに、噛まずに、水またはぬるま湯でお召し上がりください。 |
| 摂取をする上での注意事項 | ●多量摂取により疾病が治癒したり、より健康が増進するものではありません。1日の摂取目安量をお守りください。 ●妊娠中の方、妊娠の可能性のある方は医師に相談してください。 ●体質や体調により、まれに合わない時があります。その場合はご使用を中止してください。 ●薬を服用している方、通院中の方は担当専門医にご相談の上、ご使用ください。 ●1日の摂取目安量を守り、過剰摂取にならないようにご注意ください。 ●鉄の吸収を阻害する可能性がありますので、貧血のお薬を服用している方はご注意ください。 |
| 調理又は保存の方法に関し特に注意を必要とするものにあっては当該注意事項 | 無 |
| 消費者庁URL | https://www.fld.caa.go.jp/caaks/s/cssc01/fwccd01?c__id=a09F900004skSQYIA2 |
安全性に関する基本情報
安全性の評価方法
■既存情報による安全性試験結果の評価により、十分な安全性を確認している。
当該製品の安全性に関する届出者の評価
◆ターミナリアベリリカ由来没食子酸
1 食経験の評価
本品の機能性関与成分を含む原材料は、ターミナリアベリリカ果実の水抽出物である。同果実は、インド伝統医学アーユルヴェーダで単独使用や調合物トリファラに配合し粉末を水で煮出す等で摂取されている。没食子酸は国内で食品添加物(既存添加物)として食品に用いられている。
2 安全性試験に関する評価
厚生労働省の報告書では、没食子酸は「ヒトの健康に対して有害影響を及ぼすような毒性はないと考えられた」と結論づけられている。文献調査でターミナリアベリリカ果実の水抽出物の安全性試験の報告があり、安全性の懸念となる情報は認められなかった。本品の機能性関与成分を含む原材料で下記安全性試験が実施され、安全性の懸念となる情報は認められなかった。
・ラット急性・亜急性や遺伝毒性(細菌・ほ乳類培養細胞・げっ歯類)試験
・ヒト12週長期摂取や4週過剰摂取試験(本品の機能性関与成分として、順に79.6 mg/日、398 mg/日)
◆ブラックジンジャー由来ポリメトキシフラボン
既存情報の調査では、機能性関与成分「ブラックジンジャー由来ポリメトキシフラボン」を含むブラックジンジャー抽出物を用いた臨床試験の報告が行われていた。本届出商品と同じ1日摂取目安量での12週間摂取の試験や、5倍量での4週間摂取の試験において安全性に問題となる事象は報告されていないことから、ブラックジンジャー抽出物及び機能性関与成分の安全性は高く、問題はないと考えられた。
◆医薬品との相互作用
2次情報で、ターミナリアベリリカ果実の医薬品との相互作用について懸念となる情報は認められなかった。ただし、文献調査を行った結果、没食子酸が鉄の吸収に影響を及ぼす可能性が否定できなかったため、摂取する上での注意事項を表示することとした。この注意喚起により、本品の利用者に対して注意を促し、本品摂取により想定される健康被害を防止できると考えられる。
◆機能性関与成分同士の相互作用
相互作用を示す報告はなかった。
◆まとめ
本品の機能性関与成分を含む原材料は安全性に懸念はないと考えられた。なお、これら以外の原材料は、本品の配合量においては安全性に問題はなく、適切に摂取する上で安全性に懸念はないと考えられる。
機能性に関する基本情報
機能性の評価方法
■最終製品ではなく、機能性関与成分に関する研究レビューで、機能性を評価している。
当該製品の機能性に関する届出者の評価
◆ターミナリアベリリカ由来没食子酸(以下TB)
【A: 食後の中性脂肪に及ぼす影響】
1 標題
TBによる食後中性脂肪に及ぼす影響
2 目的
健常成人におけるTBの摂取が、プラセボと比較して食後中性脂肪の上昇を抑える機能を有するか検証することを目的とした。
3 背景
TBは脂肪分解酵素の阻害作用を有し、その作用により食後中性脂肪の上昇を抑制するとの報告があり、TBの食後中性脂肪の上昇を抑える機能について総合的に評価するため、システマティックレビュー を実施した。
4 レビュー対象とした研究の特性
健常成人(空腹時血中中性脂肪値150mg/dL未満)を対象に、TB摂取による食後血中中性脂肪の曲線下面積(AUC)または食後血中中性脂肪推移への影響を、プラセボと比較した論文を評価対象とした。文献を検索し、文献の内容を精査したところ、採用文献は3報となった。
※曲線下面積(AUC):吸収量を反映する指標として知られている
5 主な結果
3報の採用文献はいずれもランダム化比較試験という信頼性の高い研究であった。
健常成人男女を対象とし、TB20.8 mg/回または31.4 mg/回を摂取させた結果、プラセボ摂取と比較して、負荷食品(脂肪を含む食品)摂取後の血中中性脂肪変化量の AUCの有意な低下及び血中中性脂肪の 変化量の有意な上昇抑制が認められた。
6 科学的根拠の質
本システマティックレビューに存在する限界として、症例減少バイアス等のバイアスリスクが存在する可能性は否定できない。また採用文献が3報と少ないことから、潜在的に出版バイアス等が存在する可能性は否定できない。一方で、非直接性、非一貫性、不精確に問題は見られなかった。これらの評価結果を総括し、エビデンス総体の確実性は「高(A)」と評価した。すなわち、健常成人において、ターミナリアベリリカ由来没食子酸20.8 mg/回の摂取は、食事の脂肪の吸収を抑えて、食後中性脂肪の上昇を抑える機能を有すると考えられた。
【B: 食後の血糖値に及ぼす影響】
1.標題
TBによる食後血糖に及ぼす影響
2.目的
健常成人におけるTBの摂取が、プラセボ(偽薬)と比較して、食事の糖の吸収を抑えて、食後血糖の上昇を抑える機能を有するか検証することを目的とした。
3.背景
TBは糖質分解酵素の阻害作用を有し、その作用により食後血糖の上昇を抑制するとの報告があり、TBの食後血糖の上昇を抑える機能について総合的に評価するため、システマティックレビューを実施した。
4.レビュー対象とした研究の特性
健常成人を対象に、TB摂取による食後血糖(評価指標:食後血糖の曲線下面積(AUC)または食後血糖推移への影響を、プラセボと比較した論文を評価対象とした。文献検索し、論文の内容を精査したところ、採用論文は3報となった。
※曲線下面積(AUC):吸収量を反映する指標として知られている
5.主な結果
採用論文は3報のみであったが、いずれもランダム化比較試験であり、健常成人男女を対象とし、負荷食摂取前にTB20.8 mg/回を摂取させた際の食後血糖のAUC及び食後血糖推移に対する影響を評価していた。採用した3研究についてメタアナリシスを実施した結果、TB摂取による食後血糖の変化量のAUCの有意な低下及び食後血糖の有意な上昇抑制が認められた。
6.科学的根拠の質
本システマティックレビューに存在する限界として、症例減少バイアス等のバイアスリスクが存在する可能性は否定できない。また採用文献が3報と少ないことから、潜在的に出版バイアス等が存在する可能性は否定できない。一方で、非直接性、非一貫性、不精確に問題は見られなかった。これらの評価結果を総括し、エビデンス総体の確実性は「高(A)」と評価した。すなわち健常成人において、TB20.8 mg/回の摂取は、食事の糖の吸収を抑えて、食後の血糖値上昇を抑える機能を有すると考えられた。
【C:内臓脂肪、皮下脂肪とBMIに及ぼす影響】
1.標題
TBによる体脂肪に及ぼす影響
2.目的
健常成人においてTBの摂取が、プラセボと比較して体脂肪を低減する機能を有するかについて検証することを目的とした。
3.背景
TBは、内臓脂肪及び体重を低減するとの報告があるが、TBの体脂肪を低減する機能について最新の臨床試験の報告も含めて調査した研究レビューは見当たらないことから、体脂肪を低減する機能について検証することとした。
4.レビュー対象とした研究の特性
健常成人を対象に、TBの摂取による体脂肪への影響を、プラセボと比較した文献を評価対象とした。文献を検索し、内容を精査したところ、採用文献は2報となった。
5.主な結果
採用文献とした2報はいずれもランダム化比較試験で肥満気味の健常成人男女を対象としており、TBを41.6 mg/日摂取させた際の腹部脂肪面積、体重、BMI、胴囲・腰囲に対する影響を評価していた。
採用した2研究についてメタアナリシスを実施した結果、TB摂取による腹部内臓脂肪面積、腹部皮下脂肪面積、腹部全脂肪面積、体重、BMIの有意な低減が認められ、TB41.6 mg/日の摂取で効果が確認された。
6.科学的根拠の質
本システマティックレビューの限界として、個々の研究について症例減少バイアス等のバイアスの混入は否定できない。また、採用文献が2報と少ないことから潜在的に出版バイアス等が存在する可能性は否定できない。一方で、腹部脂肪面積、体重、BMIにおけるエビデンスの総体の確実性は非直接性、不精確、非一貫性に問題は認められず、全研究のバイアスリスク、その他のバイアスを考慮して、「高(A)」と評価した。すなわちTB41.6 mg/日の摂取は、体脂肪を低減する機能を有すると考えられた。
◆ブラックジンジャー由来ポリメトキシフラボン
1.標題
ブラックジンジャー由来ポリメトキシフラボン摂取による、腹部の脂肪を減らす機能に関する研究
2.目的・背景
BMIが高めの健康な方がブラックジンジャー由来ポリメトキシフラボンを継続摂取した場合の腹部の脂肪に与える影響に関する有効性を検証していた。
ブラックジンジャー由来ポリメトキシフラボンの脂肪に対する影響に関して、in vitro実験や動物実験では、脂肪分解促進作用があるという研究報告がある。しかし、ヒトを対象とした文献を包括的に整理するレビューでは、脂肪に対する影響を評価したものはなかった。そのため、ブラックジンジャー由来ポリメトキシフラボン摂取による、腹部の脂肪に与える影響に関する本レビューを評価した。
3.レビュー対象とした研究の特性
国内外のデータベースを使用して、検索対象期間は設けずに検索(最終検索日2023年9月8日)し、基準に該当したランダム化比較試験の研究2報を採用していた。採用研究はいずれも、20-64歳の、BMIが高めの健康な日本人成人男女を参加者とした試験で、解析対象者に脂質異常・高血糖・高血圧に該当する参加者は含まれなかった。いずれの研究も丸善製薬株式会社が費用負担した研究であったが、本レビューは採用研究の論文著者を除いた社員により公正に実施されていた。
4.主な結果
メタアナリシスの結果、ブラックジンジャー由来ポリメトキシフラボン摂取で、腹部内臓脂肪面積に対する標準化平均値差(以下、SMD)での効果推定値と95%CIは-0.57〔-0.92, -0.21〕、I統計量はI2=0%、腹部総脂肪面積に対しては-0.49〔-0.84, -0.14〕、I統計量はI2=0%であった。採用研究2報の全参加者に有害事象の報告はなかった。そのため、ブラックジンジャー由来ポリメトキシフラボンの摂取は、有害事象を示すことなく機能性(腹部の脂肪(内臓脂肪、腹部総脂肪)の減少)が期待できる。
5.科学的根拠の質
バイアスリスク、非直接性、非一貫性及び不精確は低、その他(出版バイアスなど)は中のため、エビデンス総体の和は-1であった。限界として、採用研究が2報で出版バイアスが否定できなかったことが挙げられるが、研究は肯定的な内容であり、エビデンスの確実性は「高(A)」と評価されており、腹部の脂肪を減らす機能について、肯定的な結果であると評価した。