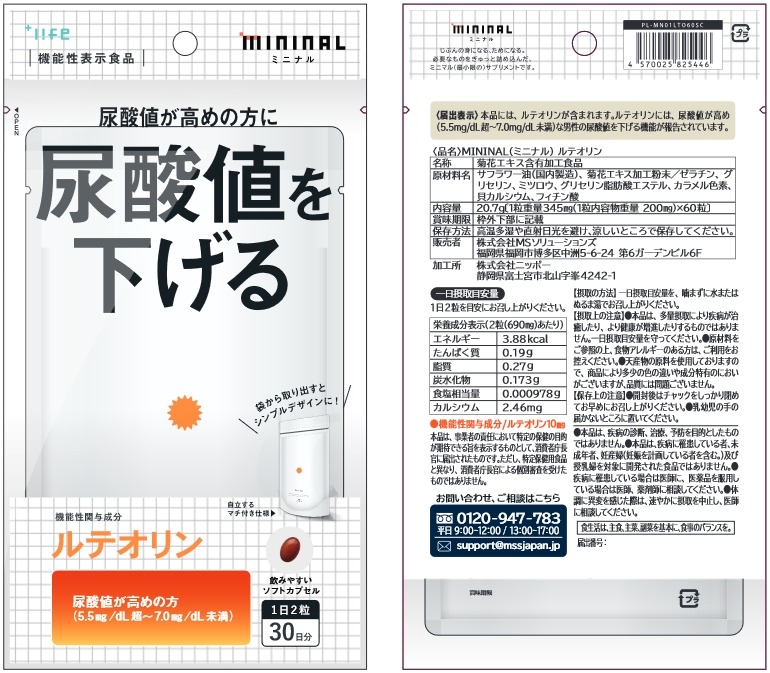
| 届出番号 | F773 |
| 商品名 | 尿酸ヘルプ |
| 届出者名 | 小林製薬株式会社 |
| 届出日 | 2021/01/05 |
| 変更日 | – |
| 撤回日 | – |
| 販売中 | 販売休止中 |
| 食品の区分 | 加工食品(サプリメント形状) |
| 機能性関与成分名 | ルテオリン |
| 表示しようとする機能性 | 本品にはルテオリンが含まれます。ルテオリンには尿酸値が高め(5.5mg/dL超~7.0mg/dL未満)な男性の尿酸値を下げる機能が報告されています。 |
| 当該製品が想定する主な対象者 | 尿酸値が高め(5.5mg/dL超~7.0mg/dL未満)な健常人男性(疾病に罹患している者、未成年者を除く。) |
| 一日当たりの摂取目安量 | 2粒 |
| 一日当たりの摂取目安量当たりの機能性関与成分の含有量 | 機能性関与成分名:ルテオリン 含有量:10 mg |
| 保存の方法 | 直射日光を避け、湿気の少ない涼しい所に保存してください。 |
| 摂取の方法 | 1日2粒を目安に、かまずに水またはお湯とともにお召し上がりください。 |
| 摂取をする上での注意事項 | ●1日の摂取目安量を守ってください。 ●乳幼児・小児の手の届かない所に置いてください。 ●食物アレルギーの方は原材料名をご確認の上、お召し上がりください。 ●原材料の特性により色等が変化することがありますが、品質に問題はありません。 ●本品は、飲酒を勧めるものではありません。 |
| 調理又は保存の方法に関し特に注意を必要とするものにあっては当該注意事項 | 無 |
| 消費者庁URL | https://www.fld.caa.go.jp/caaks/cssc02/?recordSeq=42005270290104 |
安全性に関する基本情報
安全性の評価方法
■既存情報による安全性試験結果の評価により、十分な安全性を確認している。
当該製品の安全性に関する届出者の評価
1. 食経験
本製品の喫食実績はありません。
2. 既存情報による安全性の評価
原材料である菊の花または菊の花抽出物に関してヒトやラットを対象にした安全性に関する報告が4研究報告されており,その中で有害事象を示す報告は認められませんでした。
3. 安全性試験結果
本品に使用した機能性関与成分を含む「菊の花エキス」の安全性を評価しました。急性毒性試験及び反復投与試験において異常は認められませんでした。また,変異原性試験においても異常は認められませんでした。さらに,過剰量(適正量の5倍量)摂取時の安全性評価においても,安全性上の問題となる事象は認められませんでした。
4. 医薬品との相互作用
データベースを検索した結果、併用が禁忌の医薬品はないこと、および表示見本に「疾病に罹患している場合は医師に、医薬品を服用している場合は医師、薬剤師に相談してください。」との記載があることから、健常者が適切に摂取する場合においては安全性に問題はないと判断しました。
5. まとめ
以上より,機能性関与成分「ルテオリン」を配合した本品を販売することに問題はないと判断しました。
機能性に関する基本情報
機能性の評価方法
■最終製品ではなく、機能性関与成分に関する研究レビューで、機能性を評価している。
当該製品の機能性に関する届出者の評価
標題
ルテオリンの摂取が血清尿酸値に及ぼす影響に関する研究レビュー
目的
健康な成人がルテオリンを摂取した場合,プラセボ(有効成分を含まない食品)を摂取した人に比べて血清尿酸値が改善するか検証することを目的としました。
背景
ルテオリンは菊の花の主要なポリフェノール成分であり,抗炎症作用や血清尿酸値低下作用が報告されています。しかしながら,血清尿酸値への有効性におけるルテオリンの効果を検証した研究レビューはありませんでした。そこで,ルテオリンの機能性を検証するため,本研究レビューを実施しました。
レビュー対象とした研究の特性
複数の研究論文データベースを用いて,健康な成人がルテオリンを摂取した臨床試験論文について,2019年10月30日までに発表されたものを収集および調査しました。最終的にランダム化二重盲検プラセボ対照比較試験の結果を報告した1報を評価しました。
主な結果
評価した1報の論文中には2つの臨床試験について報告されており,1つは単回摂取試験でもう1つは4週間の継続摂取試験でした。評価した結果,ルテオリンの単回摂取では血清尿酸値に効果がありませんでしたが,ルテオリンを1日当たり10 mg,4週間摂取した場合では,血清尿酸値が高めの被験者において血清尿酸値が有意に改善することがわかりました。
科学的根拠の質
今回の検証の結果から,ルテオリンを1日あたり10 mg継続摂取することは,健常成人男性において高めの血清尿酸値の低下効果が期待できます。しかしながら,バイアスの混入が完全には否定できず,サンプルサイズ及び期間ともに十分とは言えないので,今後更なる有効性及び安全性の検証が必要です。