この記事では、機能性表示食品制度が始まり、活用される機会の増えたシステマティックレビューについてご説明します。
システマティックレビューは、機能性表示食品制度だけでなく、他の分野でも使われるものです。
システマティックレビューが詳しくわからないために、機能性表示制度の利用につまづいている企業もいらっしゃるかもしれません。
今回の記事を見て、参考にしてみてください。
システマティックレビューとは?

システマティックレビューが用いられるのは、臨床統計学です。
システマティックレビューの説明に入る前に、少しだけ臨床統計学などの用語の定義を再確認しておきましょう。
医学は科学の一分野として客観性・普遍性を重視します。一方、医療は医学を基礎に人間性や安全性を加味します。臨床統計学は、医学としての臨床研究を臨床の現場で客観的に評価・適用するためのツールです。
母集団(真実・普遍)の一部の標本を用いて行われる臨床研究の結果(エビデンス)は、そのまま母集団の特性として一般化できるのでしょうか?
臨床研究の結果は事実ですが、真実であるとは限りません。さまざまな要因の影響を受けるので、そのまま結果を鵜呑みにするのは危険です。臨床統計学は臨床における不確実を制御するツールです。
どんなに精巧に企画された臨床研究であってもバイアスや偶然の影響が全くないわけではありません。そこで多くの研究を収集統合し、再分析することでそれらの影響をできる限り減らそうという解析研究法が「システマティックレビュー」(systematic review:SR)と「メタアナリシス」(meta-analysis)です。
「システマティックレビュー」(systematic review:SR)を理解することで、研究結果の解釈や効果の予測などを客観的に行うのに役立ちます。勘や経験だけに基づく判断は危険で一貫性がありません。
システマティックレビュー(系統的レビュー)の意味

学術雑誌に掲載されるレビューは、あるテーマについて複数の研究データを検討したもので、それらは記述レビューと「システマティックレビュー」(systematic review:SR)とに分けることができます。
「記述レビュー」(narrative review)は、著者の考察によって構成されるもので、客観的な精度を高めることは重要視されていません。
反対に「システマティックレビュー」(systematic review:SR)は、客観的に事実を記載することを重要視したレビューで、「メタアナリシス」(meta-analysis)などの統計処理を含みます。メタアナリシスの特徴を捉えるために、記述レビューとシステマティックレビューを比較してみましょう。
両者に共通していることは、疑問から問題点を明確にして、関連する研究データを集め、その中から利用するデータを選び出して、分析し、公表することです。レビューの全体像は似ているといえます。しかしその一方で、両者には大きな違いがあります。
記述レビューでは、データを客観的に選択する基準がなく、レビューを行う人物の主観でデータが選ばれます。分析には統計学的方法は使用されず、著者が選び出した論文を並べることにとって分析が行われます。記述レビューでは、主観を排除することができないためにシステマティックレビューに比べて、基準を明確に提示しないために精度、再現性で劣ります。
これに対し、システマティックレビューでは選択基準は明確に提示する必要があり、その分析には統計学的方法が使用されます。
メタアナリシスを用いることによって、客観性や精度の高いシステマティックレビューを記述することができます。メタアナリシスの客観性に長けているという特長を生かすためにも分析は思慮深く、慎重に行わなければなりません。
システマティックレビュー(系統的レビュー)の方法

システマティックレビューは「系統的総説」と訳されることもありますが、あまりよい日本語訳はありません。
自分で臨床研究をデザインし、実施し、結果を解析するのが「プライマリーアナリシス」(primary analysis)です。
同じデータセットを第三者が解析するのが「セカンダリーアナリシス(secondary analysis)。
同じリサーチクエスチョンに対し、複数のスタディがある場合にそれをまとめて解析することが「メタアナリシス」(meta-analysis)です。
日本では2000年頃から診療ガイドライン(clinical practice guidelines:CPG)の作成が盛んになりました。その作成プロセスは、あるリサーチクエスチョンに複数のランダム化比較試験(randomized controlled trial:RCT)が存在する場合には、基本的にはメタアナリシスをベースにします。
2009年には、PRISMA(システマティックレビューおよびメタアナリシスのための優先的報告項目)声明」として、システマティックレビューとメタアナリシスの質を向上させるための優先度の高い項目が規定されています。
コクラン共同計画(The Cochrane Collaboration)は、1992年にイギリスで始まった医療技術評価の世界的なプロジェクトです。
7つのステップから成り、システマティックレビューを行います。
1.問題の設定
2.研究を漏れなく収集
3.各研究の妥当性の吟味
4.アブストラクトフォームに要約
5.メタアナリシスによる統計学的解析
6.結果の解釈
7.編集と定期的更新
「コクランレビュー」では、これら7つのステップのうち、5のステップ、すなわち複数の研究の結果を統計学的に統合(synthesize)する、束ねる、まとめる、あるいはプール(pool)すると表現してもよいですが、そのステップだけを「メタアナリシス」と呼んでいます。
そこで得られるものはフォレストプロット(forest plot)と呼ばれます。フォレスト、つまり森を描くというものです。またブルボグラム(blobogram)とも呼ばれます。ブルボは「壁のしみ」のことです。
日本では診療ガイドラインと関連情報を提供することを目的にMindsガイドラインセンターが厚生労働省の委託事業として運営されています。
システマティックレビューは、前半がシステマティック・サーチ、後半がそのプーリング(pooling)と覚えるとわかりやすいと思います。
1990年代からエビデンスに基づく医療(evidence –based medicine:EBM)という動きがあります。その根幹を成す考えのひとつは、エビデンスレベルの強さにはグレードがあるという考えです。
・case report(一例報告)
・case series(ケースシリーズ)
・case control study(ケースコントロールスタディ)
・cohort study(コホートスタディ)
・randomized controlled trial(ランダム化比較試験:RCT)
・double blinded RCT(二重盲検RCT:DB-RCT)
・meta-analysis(メタアナリシス)
という順に、エビデンスは強くなります。
エビデンスの強さを適格に把握するための概念として、最近はPICOという概念が提唱されています。PICOはそれぞれ patient(患者)、intervention (介入)、comparison (比較対照)、outcome (臨床結果) を意味していて、4つの観点でエビデンスを検討することで、上記のどの臨床研究に該当するかを見極められます。
ここでのメタアナリシスは、RCTのメタアナリシスを指します。観察研究を束ねたメタアナリシスもありますが、通常はRCTを束ねたものをメタアナリシスといいます。
システマティックレビューの読み方

システマティックレビューの事例として次の例を考えてみましょう。
例1-1)
薬剤Aの治療効果を未治療群と比べた論文が10編あり、そのうち2編は「治療効果あり」で、残りの8編が治療効果なしという結果でした。この場合、薬剤Aの治療効果はないといえるでしょうか。
例1-2)
薬剤Bの治療効果を未治療群と比べた論文が5編あり、全ての論文で「治療効果なし」という結果でした。この場合、薬剤Bの治療効果は本当にないといえるでしょうか。
これらの例で示される文章から、薬剤A, Bの治療効果について判断はできません。
答えはどちらも「いえない」です。
その理由を、具体的な例を提示して説明します。
表1のデータをご覧ください。10編の研究のうち研究1,2では「薬剤Aの治療効果あり」、研究3~10は「治療効果なし」で、例1-1の文章で表現される研究結果です。
表1 薬剤Aの治療効果に関するデータ(その1)
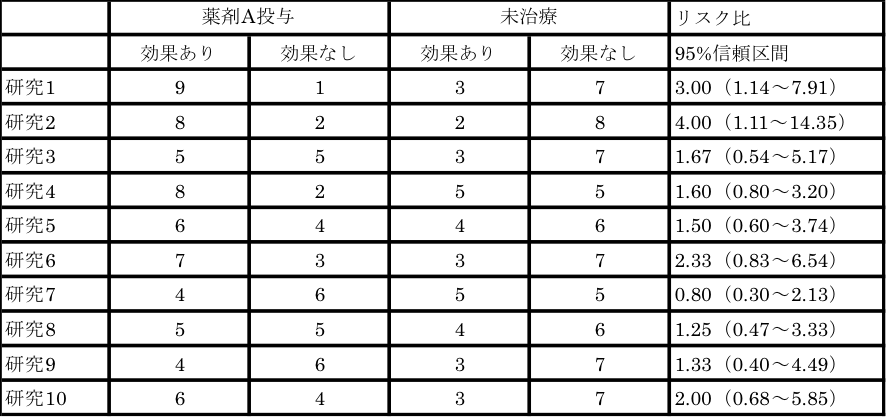
これら10編の研究を、general variance-based method(メタアナリシスの統合方法の1つ)を用いて統合すると、リスク比1.70(95%信頼区間1.25~2.32)となり、「薬剤Aは治療効果がある」という結論が得られます。
このように、メタアナリシスでは一定の見解が得られていないテーマに関する論文の結果を統合することで、一つの結論を得ることができます。
※リスク比
リスクとは、ある事象が起きる確率のことをいいます。リスク比とは、2つのリスクの比を表します。
リスク比=1:治療(+)と治療(-)で事象発生の割合が同じ
リスク比<1:治療(-)での事象発生の割合が、治療(+)より大きい
リスク比>1:治療(+)での事象発生の割合が、治療(-)より大きい
リスク比の95%信頼区間が1を含まない場合、リスク比を以下のように解釈できます。
リスク比<1:統計学的有意に、治療(-)での事象発生の割合が、治療(+)より大きい
リスク比>1:統計学的有意に、治療(+)での事象発生の割合が、治療(-)より大きい
次に表2をご覧ください。表1と同様に、例1-1で表現される研究結果です。
例1-1)
薬剤Aの治療効果を未治療群と比べた論文が10編あり、そのうち2編は「治療効果あり」で、残りの8編が治療効果なしという結果でした。この場合、薬剤Aの治療効果はないといえるでしょうか。
表2 薬剤Aの治療効果に関するデータ(その2)
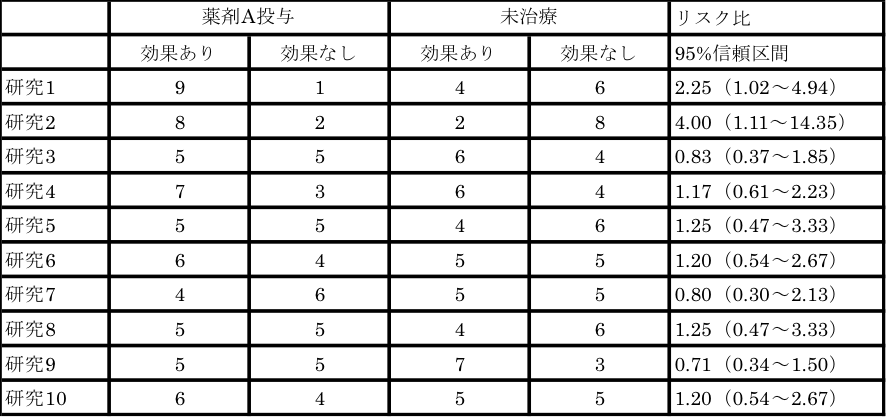
これら10編の研究を、general variance-based method法で統合すると、リスク比1.19(95%信頼区間0.91~1.55)となり、「薬剤Aは治療効果がない」という、表1と異なる結論になります。
今度は、例1-2)について具体例を提示します。
例1-2)
薬剤Bの治療効果を未治療群と比べた論文が5編あり、全ての論文で「治療効果なし」という結果でした。この場合、薬剤Bの治療効果は本当にないといえるでしょうか。
表3 薬剤Bの治療効果に関するデータ(その1)
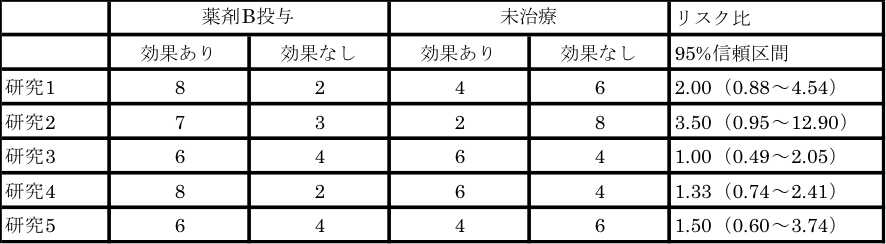
表3は個々の研究では薬剤Bの治療効果を認めておらず、例1-2)で説明できる研究結果です。general variance-based methodで統合すると、リスク比は1.46(95%信頼区間1.03~2.08)、表3の研究の統合結果では「薬剤の治療効果あり」という結論が得られます。
表3の統合により、それぞれの研究での統計学的検出力(Power)不足が補われ、個々の研究では認められなかった薬剤Bの効果が、統合により認められました。
メタアナリシスでは以上の例から分かるように、
・異なる結果を示した論文を統合して一定の結論を得る
・検出力を上げる
ことを目的とした解析が可能です。
システマティックレビューの書き方

テーマの決定と仮説の設定
メタアナリシスはテーマの決定により開始されます。テーマは具体的で的を絞ったものが良いでしょう。また、医学の発展や日常の診療に貢献するテーマでなければ分析をする意味があまりありません。
テーマを決めたら仮説(hypothesis)を設定します。仮説とは、経験や推論から作り出される「正しいと仮定された考え」のことです。
さて、仮説を設定したら分析を進める前に少し文献を調べてみましょう。関連する多くの文献を得ることができることもあれば、今考えた仮説が既にメタアナリシスによって解析されていることもあります。
既に調べられている場合でも、見つけ出したレビュー記事が記述レビューであればメタアナリシスを行う意義が十分にあります。また、記事の解析方法がメタアナリシスであってもすぐにあきらめることはありません。
例えばメタアナリシスが5年前に行われていて、同じテーマの一次的研究が複数ある場合や、メタアナリシス自体が適切に行われていなかった場合には再解析の意義が十分にあるでしょう。
仮説の証明方法の決定
テーマが決まり、仮説を設定したら、次に仮説をどのようにして証明するかを決めなくてはなりません。
仮説の証明には一次的分析と同様に、評価指標(エンドポイント)を設定する必要があります。一次的分析では評価指標を定めたら、研究デザインを決定します。しかし、メタアナリシスでは研究デザインは現在のところ唯一ですから、決定の必要はありません。
収集資料の適格基準の設定
メタアナリシスでは、テーマに関係する研究を収集した後、統計学的解析のためのデータを抽出します。インターネットが普及した現在では、PubMedを利用すれば、自宅でも無料で医学文献データベースであるMELINEに適格な検索式を入力して文献検索ができます。
ただしせっかく苦労して集めた研究データだからといってその全てを利用するのは適切ではありません。メタアナリシスに適格である研究を選択するために、適格基準を設定する必要があります。適格基準には研究デザイン、研究が行われた時期などがあります。
さて、資料の適格基準はなぜプロトコールの作成時に考えておくのでしょうか。これはメタアナリシスの正当性に影響を及ぼす重要なポイントです。
適格基準は統計学的解析の前に必ず決定しなければなりません。なぜなら、データを抽出後やデータ統合後に適格基準を作成すると、都合の良い結果を導くためにデータを選択することが可能になるからです。
データを統合して思わしくない結果が出た場合、統合した研究の中で都合の悪い研究を除外すれば、望みどおりの結果を導くことができてしまいます。
しかし、これでは客観的なデータの統合などできません。収集資料の適格基準は、遅くとも統計学的解析前つまり数値データを眺める前までに決定し、プロトコールにきちんと記載しておくことが大切なポイントです。
統合方法について
メタアナリシスのデータ統合方法には、大きく分けて母数効果モデルによる方法と変量効果モデルによる方法の2種類があります。
母数効果モデルは「収集した研究で治療の効果があったか」という分析に、変量効果モデルは「将来、治療の効果があるのか」という分析に向いています。
したがって、分析の目的によって統合方法を選択する場合があります。
統合データの検討方法の決定
メタアナリシスでは、研究データの統合結果について検討します。
その方法として、適格基準や交絡因子などを検討する感度分析、公開バイアスの検出とその対策があります。
プロトコールの作成時には、感度分析の具体的な方法や、公開バイアスの検出方法を決定しておきます。あらかじめ決定しておくのは、メタアナリシスの分析者が、都合の良い結果を導き出さないためです。
まとめ
システマティックレビュー、メタアナリシスとは、バイアスや偶然の影響を最小限にするための解析方法で、ともに複数の臨床研究の統合再解析です。
システマティックレビューはEBM式の検証手順でまとめた分析です。
メタアナリシスを実施することで、次のことが期待できます。
・研究結果の統計学的検出力(power)の増強
・研究報告によって結果が相反する場合の不確実性を解決
・効果の大きさの推定精度の向上
・個々の研究終了後に生じた臨床的疑問の解決
機能性表示食品制度では、このシステマティックレビューが効果的に行われていないものが見受けられます。
これでは、せっかく時間とお金をかけて機能性表示食品の届出申請をしたのに、無駄になってしまいかねません。
さらに、システマティックレビューが正しく行われていても、企業が営利活動として売れる商品を作ることを考えると、証明した機能性や商品が効果的とは思われないものもあります。
市場を見定め、システマティックレビューを行っていきましょう。








コメント